Recherche

Recherche

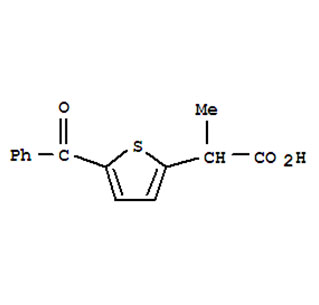
La préparation des ipa est l'étape initiale de la recherche et du développement de médicaments et la base de la recherche et du développement de médicaments. Il fournit principalement des informations détaillées pour la recherche de qualité, fournit des processus de préparation qui répondent à la production industrielle, et fournit la recherche en pharmacologie et en toxicologie, la recherche de préparation et la recherche clinique dans le processus de recherche et de développement de médicaments. Fournir des api qualifiées. Ensuite, jetons un oeil à quels problèmes devraient être prêtés attention dans la recherche sur le processus de préparation des matières premières?
Dans les documents d'enregistrement de la demande, il est nécessaire d'expliquer en détail le contexte de la recherche, la base du processus de préparation et la route. S'il s'agit d'un médicament avec une nouvelle structure chimique, la base et le principe de la création doivent être expliqués. S'il s'agit d'un médicament générique, plusieurs voies de documentation différentes devraient être fournies aux fins d'analyse et de comparaison, en détaillant les raisons de la voie adoptée et en expliquant comment elle a été améliorée. Et base d'amélioration. L'évaluation des itinéraires synthétiques vise à garantir la stabilité de la qualité du produit, en mettant particulièrement l'accent sur la faisabilité, la contrôlabilité, la stabilité, l'avancement et la rationalité de la sélection et de la conception des itinéraires de processus.
Dans les "directives techniques pour la recherche sur les médicaments chimiques" récemment publiées, il est également souligné que les matières premières comprennent les matières premières, les solvants, les catalyseurs, etc. de la réaction. Il a également souligné que le certificat de source légal et les voies de traitement et normes de qualité connexes devraient être fournis pour les intermédiaires spéciaux, et les matières premières utilisées dans la production de médicaments devraient être achetées à des unités qui respectent la réglementation.
Dans le processus de préparation d'api, la qualité des matériaux de départ, des réactifs et des solvants est directement liée à la qualité du produit et à la stabilité de la voie de traitement. Les différentes spécifications des matériaux de départ, des réactifs et des solvants affecteront directement le processus, et la qualité différente des matériaux de départ, des réactifs et des solvants introduira différentes impuretés.
Pour l'itinéraire de processus adopté, il est nécessaire d'écrire la formule de réaction chimique détaillée, les conditions de réaction et les étapes de fonctionnement, d'indiquer la quantité d'intrant, le rendement, la source de matières premières et les spécifications, et fournir un diagramme de processus. La méthode de contrôle du point final de chaque réaction par étape, les méthodes de purification et de contrôle de la qualité des principaux intermédiaires et produits finis doivent être expliquées en détail, et les données ou la carte correspondantes doivent être fournies pour assurer la qualité du produit final. Pour les substances apparentées ou d'autres produits intermédiaires qui peuvent être produits ou mélangés au cours du procédé, les méthodes de détection et les limites de contrôle doivent être expliquées.
Parce que la voie de préparation des drogues synthétiques organiques est généralement longue et affectée par de nombreux facteurs, les étapes spécifiques et détaillées de fonctionnement et les conditions du processus sont la base pour évaluer la rationalité du processus et la faisabilité des méthodes de recherche de qualité. Le contrôle du processus intermédiaire comprend le contrôle de l'intermédiaire et le contrôle des conditions du processus.
Les solvants résiduels dans les médicaments se réfèrent aux composés volatils organiques utilisés dans la production d'api pharma, aux excipients et aux préparations qui ne peuvent pas être complètement éliminés dans le processus. Les solvants résiduels sont des composants inévitables dans les médicaments.
La recherche sur le processus de production des ipa devrait comprendre deux parties: l'étape du laboratoire et la mise à l'échelle pilote. Une fois la production à petite échelle en laboratoire stabilisée, elle devrait être progressivement portée à l'échelle pilote. La production pilote est un lien indispensable dans la transition du laboratoire à la production industrielle, un pont entre les deux, et est également d'une grande importance pour l'évaluation de la propriété physique et de la stabilité de la voie du processus. Clarifier les principales tâches de la mise à l'échelle pilote; Prêter attention à l'évaluation de l'échelle pilote; Faire comprendre que l'optimisation des processus est un processus dynamique; Prêter attention à l'analyse et à la recherche des impuretés.
Autres Blogs sur les ingrédients pharmaceutiques actifs API:
Analyse de la recherche et du contrôle des impuretés dans les API
La différence entre les ingrédients pharmaceutiques intermédiaires et actifs pharmaceutiques
Les 10 meilleures entreprises de produits pharmaceutiques API dans le monde 2022

Liens rapides
Ajouter:
E-mail:
 English
English  Español
Español  français
français  العربية
العربية